芬兰赫尔辛基大学国家植物表型基础设施(the National Plant Phenotyping Infrastructure,NaPPI)是芬兰国家研究基础设施(Finnish Research Infrastructure,FIRI)的重要植物科学研究平台之一。它的核心使命是通过整合从基因组学到高通量表型组学,再到高精度代谢组学的完整技术链条,为植物科学研究提供顶尖的非破坏性表型分析技术。就在近期(2026年1月21日),NaPPI正式加入了由NordForsk(北欧国家政府间科研合作资助机构,隶属于北欧理事会部长会议框架)资助的 NordPheno北欧研究基础设施中心。这一合作旨在加强整个北欧地区在数字表型分析能力、知识交流、设施共享以及科研人员培训方面的合作,共同推动植物科学和育种研究。

NaPPI的核心设施为两套PlantScreen高通量植物表型成像分析系统。一套大型传送带系统适用于120cm以下的大型植株,如小麦、玉米、番茄、马铃薯等。一套紧凑式传送带系统适用于50cm以下的小型植株,如拟南芥或作物幼苗等。两套系统均可高通量自动化运行,在无人值守情况下自动完成植物样品的培养、浇灌、传送、各项表型成像测量与分析等一整套植物表型组学测量程序。同时,赫尔辛基大学还装备有多台不同型号配置的FluorCam叶绿素荧光成像系统,可配合PlantScreen系统的表型研究工作,完善部分特殊表型数据,如OJIP快速荧光动力学成像分析等。

NaPPI的大型PlantScreen高通量植物表型成像分析系统,可同时容纳270株高120cm宽100cm样品,具备叶绿素荧光成像和RGB彩色形态成像等功能。

NaPPI的紧凑型PlantScreen高通量植物表型成像分析系统,可同时容纳360株高小型样品,具备叶绿素荧光成像、RGB彩色形态成像、红外热成像等功能。系统安装于一套FytoScope大型步入式植物生长室中,可进行各种模拟光照、温度、光周期等环境条件下的表型测量
这两套PlantScreen系统在2015年安装完毕,是北欧地区最早的植物表型研究设施之一。时至今日,它们也依然是支持NaPPI乃至整个北欧地区植物表型研究的核心设施之一。NaPPI利用这些表型组学设备已经开展了一系列研究工作并取得了大量的科研成果,部分研究案例如下:
由甘薯羽状斑驳病毒(SPFMV) 和甘薯褪绿矮化病毒(SPCSV) 协同感染引起的病毒病对甘薯产量影响极为严重。传统的病毒检测方法(如核酸检测)虽然有效,但成本高、耗时,并且由于需破坏样品,无法进行连续观测。本研究旨在利用PlantScreen高通量表型分析系统,结合叶绿素荧光(ChlF)成像和热红外(TIR)成像技术,灵敏、无损并且省时省力地研究SPFMV和SPCSV在甘薯中的协同致病机理。
实验设置了6个不同的甘薯病毒处理组,在两种光照条件下进行培养,以评估环境的影响。在29天的连续培养中,定期测量RGB形态成像、叶绿素荧光成像和红外热成像。
结果表明,与健康植株(Wt-H)和仅感染SPFMV(Wt-F)的植株相比,感染SPCSV(Wt-C)、共感染(Wt-FC)以及转基因感染(R3-F)的植株生长受到显著抑制,表现为株高降低、生物量和叶面积减少。
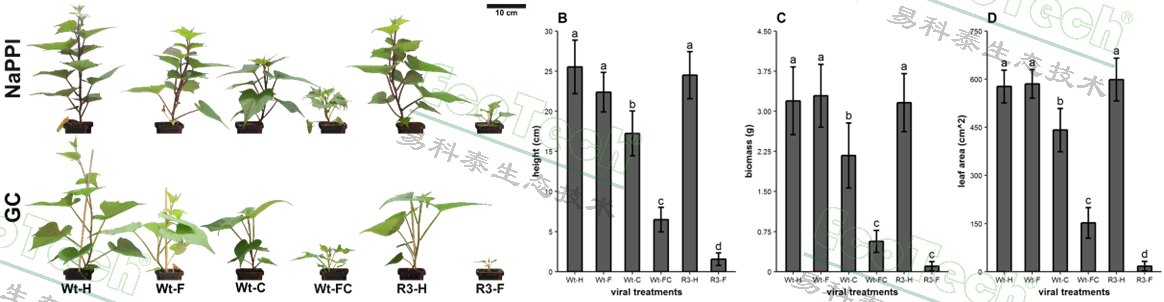
不同处理组甘薯的侧面成像图与形态数据:高度、生物量、叶面积
叶绿素荧光参数ΦPSII(PSII有效量子产量)和 qP(光化学淬灭系数)是区分不同病毒处理严重程度的最敏感参数,在感染第3天即可明显指示病害发生。症状严重的植株(Wt-FC,R3-F)这两个值均显著降低,表明其光化学反应中心效率低下。叶片温度在症状严重的植株中更高,这可能是由于气孔关闭导致蒸腾作用减少所致。TIR成像在感染早期(约7天后)就能检测到温度差异。
本研究首次系统性地验证了叶绿素荧光成像和红外热成像技术可用于区分和量化SPFMV和SPCSV在甘薯中引起的病毒病严重程度。为利用高通量表型技术进行温室科学实验和田间精准农业中的病毒病早期检测提供了重要依据。
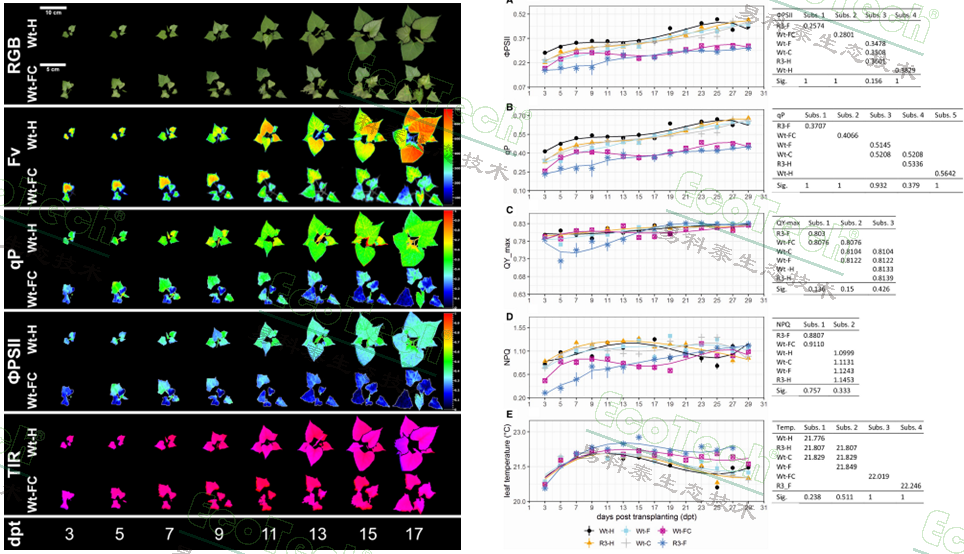
左图:不同生长时期的RGB、叶绿素荧光和热成像图;右图:各项叶绿素荧光参数的动态变化曲线
本研究聚焦于坏死性林木病原真菌——小孢子异担子菌Heterobasidion parviporum的致病机制。小孢子异担子菌是造成云杉根部和干基腐朽的最主要病原体,每年都会造成巨大的经济损失。该真菌的基因组编码大量小分泌蛋白(SSP),推测其作为效应子在与寄主互作中起关键作用,但大多数 SSP 的功能尚不明确。
通过农杆菌介导的瞬时表达技术在本氏烟叶片中测试四个能引起细胞死亡的 SSP 同源候选蛋白。结果显示,只有 HpSSP35.8 能引发强烈的组织坏死和细胞死亡,而其他同源蛋白效果微弱或无效果。用 H. parviporum 的分生孢子接种云杉幼苗根部,在不同时间点检测 HpSSP35.8 基因的表达量,发现:HpSSP35.8 的表达在侵染的早期、症状出现前(24-60小时)被强烈诱导,在36小时达到峰值,此时真菌可能正在形成侵染结构(附着胞)。当根部出现明显褐变症状(72小时后),该基因的表达水平反而显著下降。这表明 HpSSP35.8 在建立侵染的初期阶段可能扮演重要角色。但这种鉴定方法费时费力,研究人员还是需要一种高效、灵敏的方法来快速筛选和鉴定具有生物活性的效应子蛋白以开展后续工作。
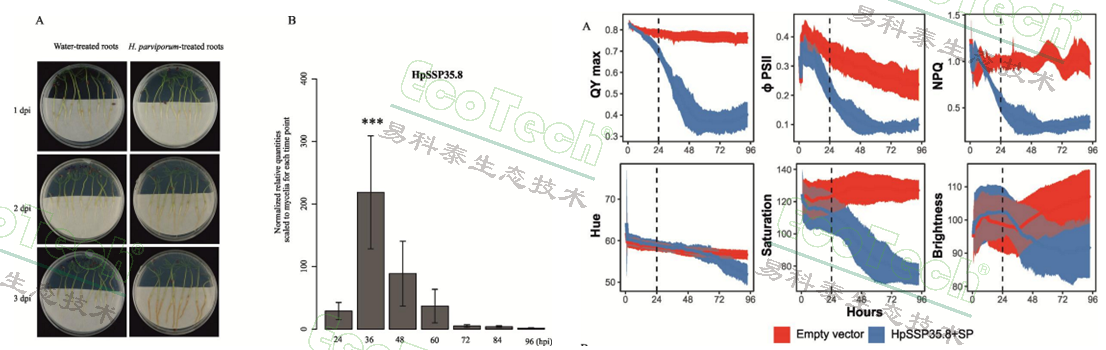
左图:接种病菌的云杉根部和HpSSP35.8的表达动力学;右图:本氏烟叶片的叶绿素荧光与RGB彩色成像参数动态变化,叶绿素荧光参数包括QYmax、ΦPSII和NPQ,RGB彩色成像图转化为色调饱和度数据(Hue-Saturation-Brightness)
于是,研究人员利用PlantScreen系统中的RGB可见光形态成像与叶绿素荧光成像功能,对瞬时表达 HpSSP35.8 的本氏烟叶片进行了动态监测。结果表明,利用可见光成像的色彩分析要到36小时才能看到明显的坏死症状。而叶绿素荧光参数ΦPSII(PSII实际光化学效率)在接种后3小时就开始显著下降;QYmax(PSII最大光化学效率)则在9小时后出现差异,从而证明叶绿素荧光参数及成像分析是比形态、色彩观察更灵敏、更早期的细胞死亡和生理胁迫指示器,可用于高效筛选其他潜在的效应子蛋白。
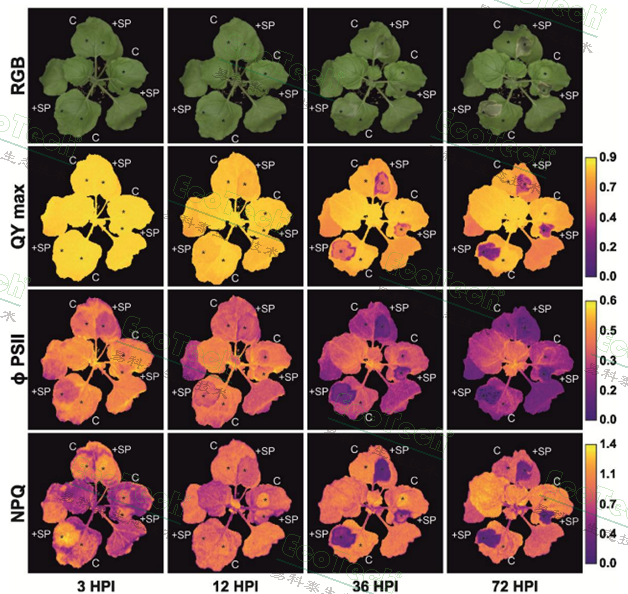
农杆菌转化本氏烟叶片的RGB成像图与叶绿素荧光成像图,可见处理3小时后ΦPSII成像图即可明显观察到HpSSP35.8的表达与影响范围
种子活力是种子发芽和出苗率、幼苗生长的潜势、植株抗逆能力和生产潜力的总和(发芽和出苗期间的活性水平与行为),是种子品质的重要指标。种子萌发实验无疑是最为直接有效的种子活力检测方法。但一般的传统方法需要人工计数来测量幼苗和计算发芽率,工作量极大,也非常耗时。而基于彩色图像分析来识别发芽幼苗又存在很大误差。同时,传统的形态数据难以真正评估幼苗生长的潜势、植株抗逆能力和生产潜力。因此,基于现代植物表型组学研究和种子活力评估要求,在种子萌发实验中还需要实时监测各种表型数据,而不仅仅是传统表型所说的形态数据。
赫尔辛基大学的研究人员为了研究一种新的ABA响应泛素E3连接酶对拟南芥种子萌发活力的影响,设计了一个基于高通量叶绿素荧光成像分析的萌发实验。
PlantScreen植物表型成像分析系统可以自动对植物样品进行连续培养和表型监测,非常适用于进行高通量的种子萌发实验。其配备的LED光照控温培养室能够模拟理想的光照与温度条件。自动传送系统可以按设置的序列自动让样品传送到成像室。内置的FluorCam叶绿素荧光成像模块可以通过监测种子萌发后刚展开子叶的最大荧光值Fm,非常有效地识别发芽的种子。专用的分析软件能够很容易地将未萌发种子和背景去除掉,从而使发芽率计算极为准确。
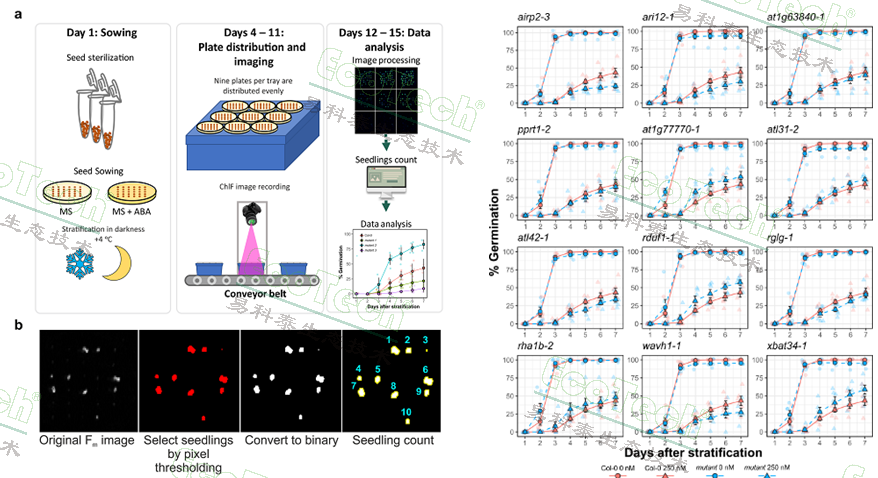
左图:高通量叶绿素荧光成像分析工作流程;a.播种、放置样品、成像测量、图像分析;b.最大叶绿素荧光Fm成像图的分析过程;右图:不同处理的发芽率动态曲线
叶绿素荧光成像同时测量萌发种苗的叶绿素荧光参数如QY_max最大光化学效率(Fv/Fm,对各种胁迫极为敏感)、QY实际光化学效率(量子产额)、NPQ非光化学淬灭(与光系统热耗散、光保护机制有关)、Rfd荧光衰减比率(也称为活力指数)、冠层面积等,可反映种苗光合能力和抗逆能力。热成像单元可以提供冠层和叶片温度数据,反映植物蒸腾、水分利用状态以及病害等胁迫信息。这些指标已经广泛用于幼苗生长潜势、植株抗逆能力和生产潜力的评估,并得到了大量的验证。本研究成功建立了一个高效、可扩展的高通量萌发筛选平台,为种子活力分析与种质资源评估提供了新工具。
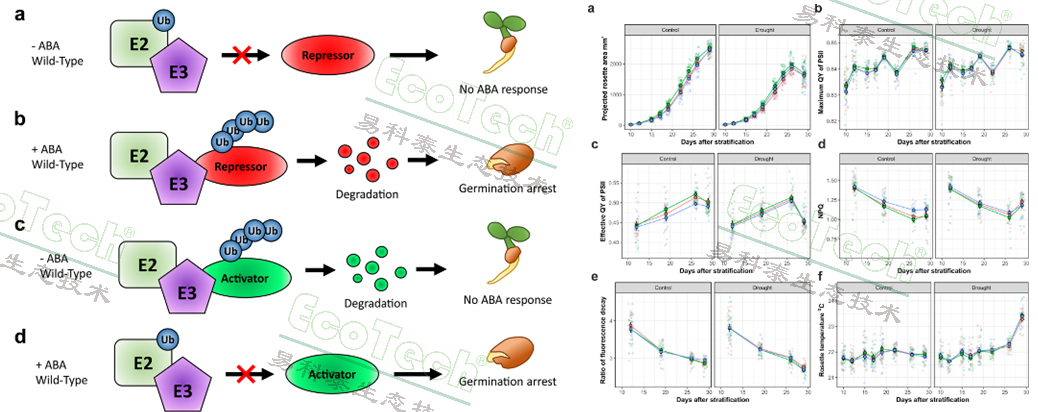
左:泛素E3连接酶在ABA反应途径中的功能假说;右:对应处理的冠层投影面积、各项叶绿素荧光参数、冠层温度的动态曲线
在高纬度地区(如芬兰在北纬60°以上),许多初生茎红树莓(Rubus idaeus L.)品种由于生长季短、秋季霜冻早,无法在初生茎上实现充分的秋季产量。这些品种虽具有高产潜力和优良果实品质,但秋季果实成熟过晚,导致产量损失。研究人员将7个初生茎树莓品种通过长枝栽培方式作为次生茎进行生产并评估其果实品质,希望为短生长季地区提供替代栽培方案。
在进行果实品质评估时,除了传统的单株产量、果重、可溶性固形物(SS)、可滴定酸(TA)等品质数据,研究人员创新性地使用PlantScreen表型成像分析系统的RGB成像单元分析果实形状和颜色参数。
果实面积直接反映果实的大小。偏心率则可以反映果实的圆度,其中“Autumn Treasure”的果实最椭圆(偏心率最高),其他品种则更接近圆形。颜色分析则表明“Kwanza”的果实是最红、最亮的。高通量RGB成像分析可高效分析果实形状和颜色,非常适用于自动化成熟度判断和采后品质评估。
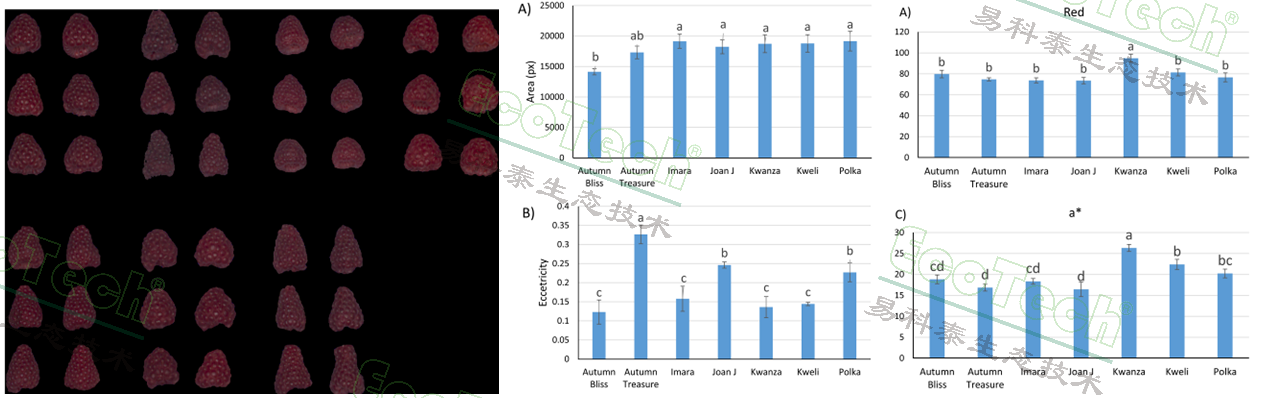
左图:经过背景去除的树莓果实RGB成像图;中图:树莓果实的形态数据:面积和偏心率;右图:树莓果实的颜色数据:平均红度和CIE数值
OJIP快速荧光诱导动力学成像一直是叶绿素荧光成像技术中的一个难点,但由于OJIP能够对叶绿素荧光进行微秒级解析,因而在植物光合机理研究中又是不可或缺的。因此科学家和工程师一直在合作开发相关技术,最终成果即为具备闪光诱导叶绿素荧光成像功能的FluorCam叶绿素荧光成像系统。
赫尔辛基大学在2019年与PSI公司合作,利用一台安装了超高速荧光相机的定制FluorCam叶绿素荧光系统对拟南芥突变体的低氧光合响应进行了PAM脉冲调制荧光和OJIP快速荧光诱导分析。之后又对拟南芥对臭氧的光合响应等进行了研究
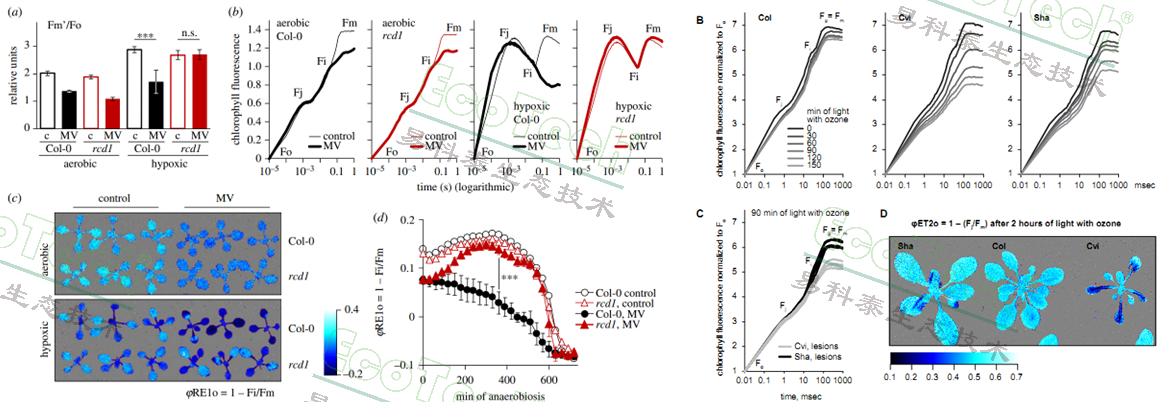
左图:拟南芥rcd1突变体在低氧环境下的OJIP曲线与φRE1o(PSI电子受体的电子流量子产额)成像图与数据(Shapiguzov,2019);右图:拟南芥在臭氧和光照处理后的OJIP曲线与成像图(Morales, 2021)
从2024年开始,赫尔辛基大学与芬兰自然资源研究所合作,利用一台最新型的PlantScreen SC植物表型成像分析系统进一步深入研究。这一系统同时配备RGB成像、红外热成像、FluorCam叶绿素荧光成像单元(配备PAM脉冲调制叶绿素荧光成像、OJIP快速闪光诱导叶绿素荧光成像两种成像模块)等功能模块。他们在除草剂影响、气孔功能胁迫响应等方面已经取得了一系列成果。
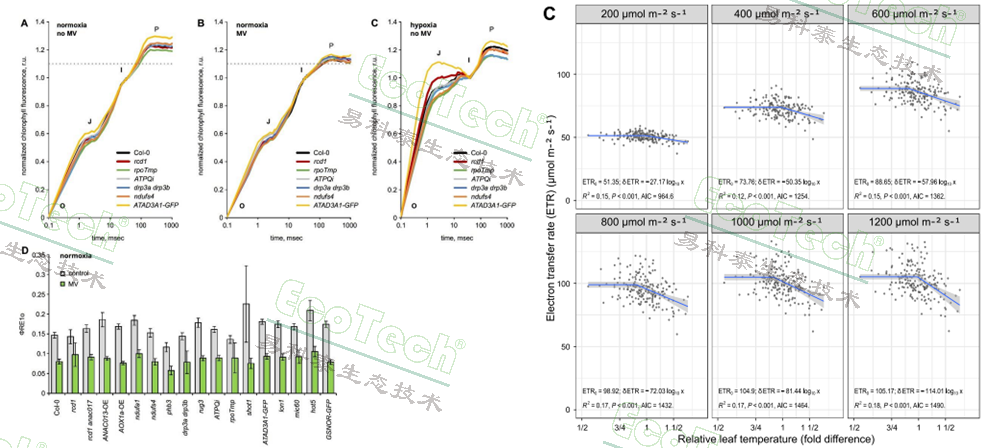
左图:拟南芥在正常含氧量环境与缺氧环境下添加或不添加百草枯(MV)的OJIP曲线与φRE1o(PSI电子受体的电子流量子产额)数据图(Punkkinen,2025);右图:蚕豆不同光照条件下相对叶温与电子传递速率ETR的相关性(Shapiguzov,2025)

PlantScreen SC植物表型成像分析系统
参考文献:
北京易科泰生态技术公司提供植物表型分析技术全面解决方案并提供相关参考文献:

左图: PlantScreen植物表型成像分析系统;右图:PhenoTron® PTS植物表型成像分析系统

左图:新一代FluorCam1300多激发光多光谱荧光成像系统;中:FluorTron®植物光合表型成像分析系统;右:利用易科泰叶绿素荧光成像技术测量番茄种子萌发率并评估种苗活力

PhenoTron®智能LED光源培养与表型分析平台与西洋参诱变育种叶绿素荧光成像(EcoTech®实验室)